Nous constatons depuis quelques décennies un grand progrès technologique basé sur l’utilisation de la lumière en tant que thérapie, proposant des méthodes innovantes et opérantes. Le terme « photomédecine » commence à émerger pour synthétiser une approche médicale interdisciplinaire basée sur la lumière avec des applications cliniques concrètes (dermatologie, cancérologie, dentisterie, chirurgie…) et des voies de recherches prometteuses (1). Les champs d’applications cliniques sont nombreux, en voici une liste non exhaustive : la photothérapie dynamique de certaines lésions cancéreuses et précancéreuses de la peau (kératoses actiniques) et autres maladies de la peau (acné vulgaris), PUVAthérapie ou photo chimiothérapie obtenue par irradiation de rayons UVA (psoriasis), cicatrisation des plaies (laser Diode, LED), photo-rajeunissement cutané par LASER (Light Amplification by Stimulated Emission of Radiation) et lampe IPL (Intense Pulsed Light) et la photobiomodulation par exposition à des lasers de basse puissance LLLT (Low Level Laser Therapy) aussi appelés « lasers froids » ou à des lampes LEDs (Light Emitting Diodes) ou diodes électroluminescentes (1.5).
Objectif
Ces rayonnements sans effets délétères directs, qu’ils soient cohérents (LLLT) ou non (LED), sont-ils réellement efficaces ? Après un bref rappel théorique, nous décrirons à travers une revue de la littérature, les modes d’actions et l’efficacité de la photobiomodulation en tant que méthode de photothérapie non thermique et non invasive. Différentes applications cliniques seront listées et discutées.
La lumière
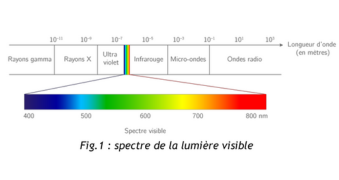
Dans le large spectre des rayonnements électromagnétiques, la lumière visible occupe une courte gamme de fréquences de propagation dont les longueurs d’onde (λ) se situent entre 400nm (bleu) et 800nm (rouge).
A contact du tissu biologique ou de l’organe éclairé, le rayonnement incident subit quatre types d’interactions :
- Réflexion
- Transmission
- Dispersion
- Absorption
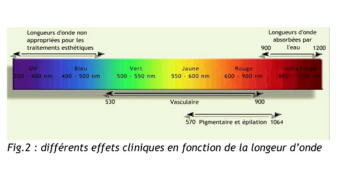
En photobiologie, l’absorption est un préalable à toute réaction biologique. L’énergie véhiculée par le faisceau incident sera absorbée par des chromophores qui sont des molécules biologiques photo accepteurs (eau, mélanine, myoglobine, hémoglobine) en fonction de la longueur d’onde λ du rayonnement pour provoquer des effets biologiques différents.