Conflit d’intérêt :
Cet article est sous la seule responsabilité de son auteur principal. Il a commandé et financé, personnellement, l’étude rhéologique, auprès du laboratoire Rheonova- France, en 2016. Les commentaires n’engagent que son avis. Ils sont le fruit de sa longue expérience avec le gel CPM®.
Depuis novembre 2011, le gel CPM® Belotero® Balance sans lidocaïne, bénéficie de l’approbation par la Food and Drugs Administration (FDA) aux USA. En 2014, la lidocaïne fut additionnée au gel. Nous avons fait quelques tests comparatifs sur les deux versions du gel (avec et sans lidocaine) (Ref 12)
En 2004, nous avions testé, pour son enregistrement au sein de la Communauté Européenne (CE), le premier gel d’acide hyaluronique (HA) monophasique cohésif polydensifié (CPM®), issu de la technique de réticulation dite “Dynamic Cross-linking Process”. A l’époque, le gel ne contenait pas de lidocaïne. De nombreux articles ont été publiés au sujet de ce gel, tant en français qu’en anglais, voire en allemand et italien. (Ref 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11)
Le gel avec lidocaïne est en cours d’enregistrement auprès de la FDA.
Nous présentons nos différents tests sur ces deux présentations du même gel. Nous ajouterons quelques données rhéologiques, ainsi que nos impressions cliniques personnelles obtenues sur plus de 1200 patients à la suite d’injection d’acide hyaluronique.
Matériel
Seul le gel CPM® Belotero® Balance, avec et sans lidocaine est l’objet du présent article. Ces gels bénéficient de la technologie de réticulation dite « Dynamic cross-linking process », menant à la CPM®.
Rhéologie
Nous avons utilisé, autant que faire se peut, les mêmes appareils en 2006 et en 2012 au sein d’un laboratoire privé, afin d’avoir des résultats de nos analyses du gel CPM® sans lidocaïne, aussi reproductibles que possible. Y avait-il modification du gel au cours du temps, ne serait-ce que du fait du problème « technique » surnommé « Flying needle »?
pH mètre
En 2006, le pH du gel « Balance® » a été mesuré par pH-Meter portable HI8424 – HANNA instruments avec une électrode spécifique pour les gels, FC200B.
En 2012, nous avons utilisé un pH meter METTLER Toledo 2009-174 modèle SevenEasy S 20
Osmomètre
Pour mesurer, en 2006 et 2012, l’osmolarité des produits « Balance® », nous avons utilisé l’Osmomètre Löser calibré.
Rhéomètre
2006 et 2012
Les mesures rhéologiques ont été effectuées avec un rhéomètre à contrainte imposée TA Instruments AR1000 (New Castle, USA) avec une géométrie plan-plan de 40 mm, un entrefer de 1000 µm et une température d’analyse de 25°C.
2016
Nous avons fait appel au laboratoire Rheonova-France, pour comparer les gels CPM® avec et sans lidocaïne. Deux lots de chaque produit ont été examinés à l’aide d’un rhéomètre DHR III (TA Instrument).
Observation visuelle et microscopique
Nous avons examiné le gel CPM® avec et sans lidocaïne, soit au sein de notre bureau de consultation, soit au laboratoire Viollier, après coloration au bleu de toluidine et rinçage de la préparation à l’eau bidistillée. (Ref 13)
A notre consultation
Nous avons utilisé comme précédemment : sérum physiologique (NaCl 0.9%), éthanol 70°, pince d’Adson, mètre-ruban, colorant Talens® bleu-violet, boite de Pétri et pot pour examen d’urine, des seringues Omnican® avec aiguille 30½G sertie pour le prélèvement du colorant Talens et de l’éthanol à 70°.
Pour les photographies, nous avons utilisé, suivant les années, un appareil Canon, film argentique Kodak,ou un appareil numérique Nikon D40X, objectif AF Micro Nikkor 60mm 1: 2.8 D. (Ref 9, 12-15)
Au laboratoire Viollier
Pour les tests d’étalement, nous avons utilisé du bleu de toluidine 0.063%, des lames et lamelles pour examen au microscope et 2X 1ml d’eau bidistillée pour rincer la préparation, après étalement et coloration. La préparation a été photographiée après étalement, entre lame et lamelle avec un appareil photographique numérique Olympus® SC100, avant d’être examinée et photographiée sous microscope.
Etudes ultrasonographiques
Les échographies ont été faites à l’Institut de radiologie MedImage. (Ref 14, 15)
L’appareil General electric logiQ E9®, avec sonde Hockey stick L8 18i ®, 17 méga-Herz a été utilisé durant chacune de ces études. Afin de parfaire l’image, nous avons placé, par-dessus la zone injectée, une interface, SonarAid GeistlichPharma®.
Histologie
Pour les analyses histologiques, les biopsies, après prélèvement, ont été conservées dans du formol et envoyées au Laboratoire Viollier. Après préparation, elles ont été colorées avec les colorants classiques et spécifiques pour ce type d’analyse (fer colloïdal, bleu Alcian, hématoxilline-éosine), puis examinées sous microscope Zeiss Axiokop 40. (Ref 14, 15, 20)
Méthode
Rhéologie
Osmomètre
En 2006 et 2012
L’osmomètre Löser calibré, utilise la méthode du point de congélation. En 2006, la mesure a été réalisée sur 3 échantillons, et, en 2012, sur 2 échantillons.
pH mètre
Les mesures ont été réalisées 2 fois sur les seringues à disposition.
En 2006
pH-mètre portable HI8424-HANNA instruments, avec une électrode calibrée, gel-
spécifique FC200B.
En 2012
pH meter METTLER Toledo 2009-174 modèle SevenEasy S 20.
Rhéomètre
2006 et 2012
Un balayage en fréquence a été effectué entre 0.1 et 10 Hz, pour une déformation comprise dans le domaine de viscoélasticité linéaire pour les valeurs des modules G’, G’’et Tan δ, à 25°, à la fréquence de 1 Hz.
2016
Au laboratoire Rheonova, les mesures ont été réalisées à l’aide d’une géométrie plan-plan rugueuse de 25mm de diamètre, la température régulée à 25° par un plan à effet Peltier. Chaque test a été effectué au moins 2 fois sur chaque échantillon, pour évaluer la reproductibilité.
Observation visuelle et microscopique
A notre consultation
Test de cohésivité
0.6ml de sérum physiologique, coloré avec 2 gouttes de colorant Talens®, prélevées au moyen de la seringue Omnican® 50, sont placés dans le pot pour examen d’urine. Au travers de l’embout de la seringue, 0.2 ml de gel sont placés au sein du sérum.
Ensuite, une légère agitation de la préparation, par rotation manuelle, est réalisée pendant quelques secondes. Le résultat est photographié. Enfin, sont ajoutées 2 gouttes d’éthanol 70°, avec une seringue Omnican® 50. Le mélange subit, à nouveau, avant photographie, une brève et légère agitation par rotation manuelle.
Test de résistance à la traction
Un mètre-ruban est placé contre la boite de Pétri.
Comme ci-dessus, 0.2ml sont déposés au centre de la boite de Pétri, par l’embout de la seringue. Ensuite, le dépôt est pris entre les mors de la pince d’Adson. Une traction manuelle, douce et délicate, est effectuée.
Au moment où le fil de gel créé par la traction va se rompre, l’ensemble est photographié.
Au laboratoire Viollier
0.1ml de gel CPM® avec et sans lidocaïne sont étalés, comme pour un frotti de sang, avec une spatule sur une lame de verre. 2 gouttes de bleu de toluidine 0.063% sont mises au contact des gels, pendant 30 secondes. Ensuite, les préparations sont rincées 2 fois avec 1 ml d’eau bistillée, au moyen d’une pissette. Le tout est ensuite placé entre lame et lamelle. La préparation est photographiée, puis examinée au microscope optique.
Etudes ultrasonographiques
Nous avons réalisé, depuis 10 ans, diverses études, comparatives ou non, entre divers gels d’HA. Chacune a permis d’injecter, sous contrôle ultrasonographique, 0.2ml des gels, dans le derme réticulaire superficiel, soit dans le derme réticulaire moyen. Toutes les injections ont été filmées et photographiées à l’institut de radiologie MedImage. (Ref 14, 15) (Fig 1)
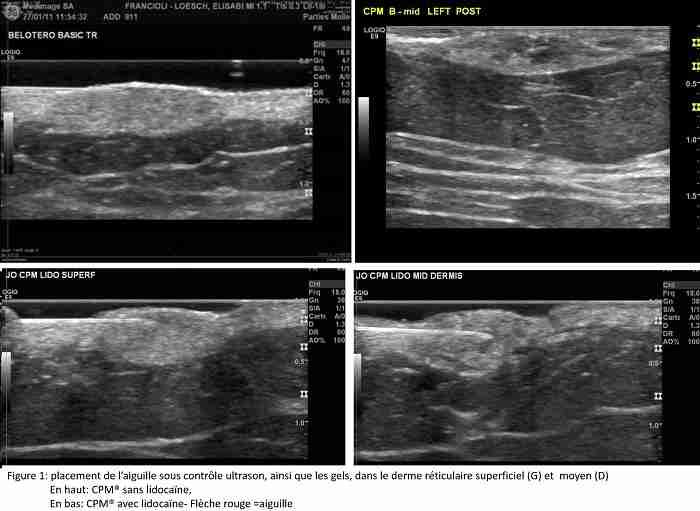
Histologie
Lors de nos études comparatives, les papules, réalisées dans la région fessières des sujets, ont été biopsiées avec un punch 4 mm, sous anesthésie locale par lidocaïne 1% sans adrénaline. Les biopsies ont été placées dans du formol, et adressées au laboratoire Viollier, pour préparation, coloration à l’hématoxilline-éosine, fer colloïdal et bleu Alcian et examen microscopique.
Résultats
Rhéologie
pH / Osmolarité
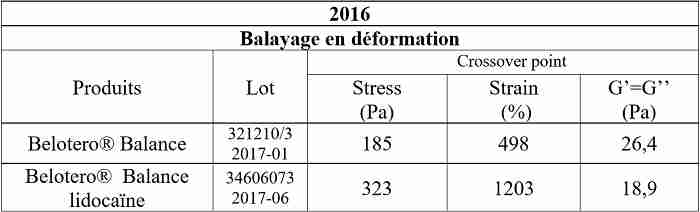
Les résultats des tests réalisés en 2006 et 20012 sont présentés dans le tableau 1.
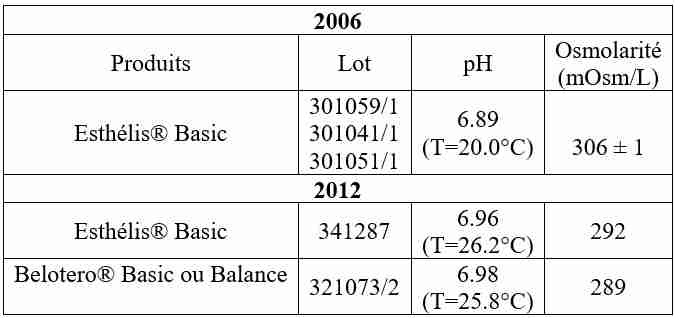
Entre 2006 et 2012, les mesures réalisées étant très proches, on peut dire que les gels CPM® présentent une grande stabilité à la fabrication, quels que soient les lots testés et les années de fabrication.
Rhéologie
2006 et 2012
Les mesures réalisées montrent, ici aussi, que tant G’, G’’ que Tan delta présentent, à la fréquence 1 Hz, des valeurs très proches. (Tableau 2)
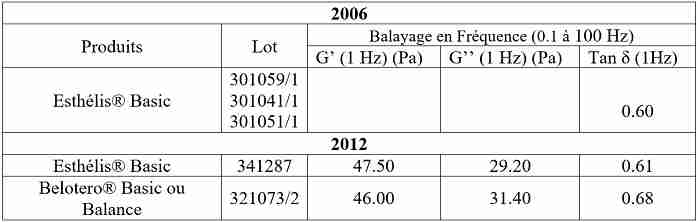
On peut considérer les valeurs trouvées comme semblables.
2016
Au laboratoire Rheonova:
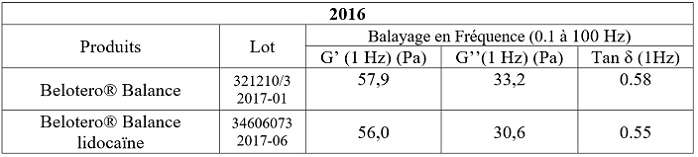
Bien que supérieures à 2006 et 2012, les gels présentent des valeurs très semblables, additionnés ou non de lidocaïne. Les gels de 2016 sont, cependant, légèrement moins fluides.
Ces nouvelles données montrent que l’ajout de lidocaïne modifie probablement les propriétés visco-élastiques du gel CPM®.
Elles laissent à penser que le gel avec lidocaïne est plus difficile à injecter, qu’il supporte plus mieux les contraintes subies, et pourrait, potentiellement, avoir une rémanence supérieure comparé au gel sans lidocaïne.
Ceci reste à démontrer à l’aide d’une étude complémentaire, permettant de suivre la rémanence des gels sur différentes sujets. Ceci permettra de voir si l’hypothèse d’une corrélation entre la durée de l’effet du gel et l’ajout de lidocaïne s’avère exact.
Observation visuelle et microscopique
A notre consultation
Depuis 2004, nous n’avons observé aucun changement de comportement du gel CPM®, additionné ou non de lidocaïne. Chacun test a été réalisé, au moins, 3 à 4 fois.
Test de cohésivité:
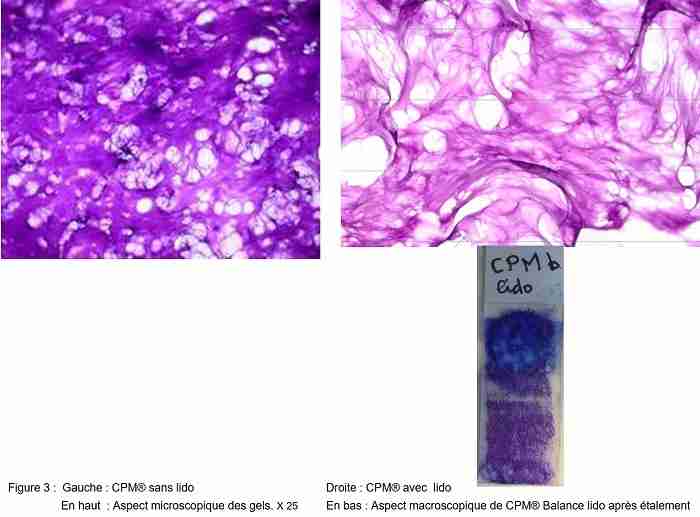
Le gel, depuis 2004, reste parfaitement cohésif. (Fig 2, en haut)
La nature cohésive du gel, ainsi que sa spécificité, monophasique cohésif et polydensifié, ont été confirmées en 2015 par les travaux des Prs. H. Sundaram, T.C. Flynn et coll. (Ref 10, 11)
Test de résistance à la traction:
Depuis 2004, le gel résiste à une traction à la pince d’Adson jusqu’à 3, voire 5 cm. (Fig 2, en bas)

Au laboratoire Viollier
Test d’étalement
A l’étalement, le gel CPM® lidocaïne présente une élasticité moyenne, un comportement relativement adhésif, cohésif. Le gel s’étale de manière homogène et ne présente pas de particule en son sein.
L’adhérence à la lame est excellente. Le gel ne présente aucune dispersion lors du rinçage à l’aide de 2 X 1ml d’eau bidistillée. Son adhérence à la lame reste excellente au cours dudit rinçage. Au microscope, le gel avec lidocaïne est semblable au gel sans lidocaïne. (Fig 3)
Ces résultats ne diffèrent donc guère de ceux observés pour le gel CPM® sans lidocaïne. (Ref 13)
Etudes ultrasonographiques
1. Injection dans le derme réticulaire superficiel.
Injection à J0 et contrôle à J15.
Injecté dans le derme réticulaire superficiel, le gel CPM® sans ou avec lidocaïne, montre une image homo-échogène, sans zone hyper- ou hypo-échogène au sein de la papule réalisée. La papule est iso-échogène par rapport au derme avoisinant non injecté. Enfin, il n’y a pas de renforcement postérieur ni cône d’ombre, tant sous la papule qu’à sa périphérie, contrairement à d’autres gels bénéficiant de l’approbation FDA. (Fig 4) (Ref 13)
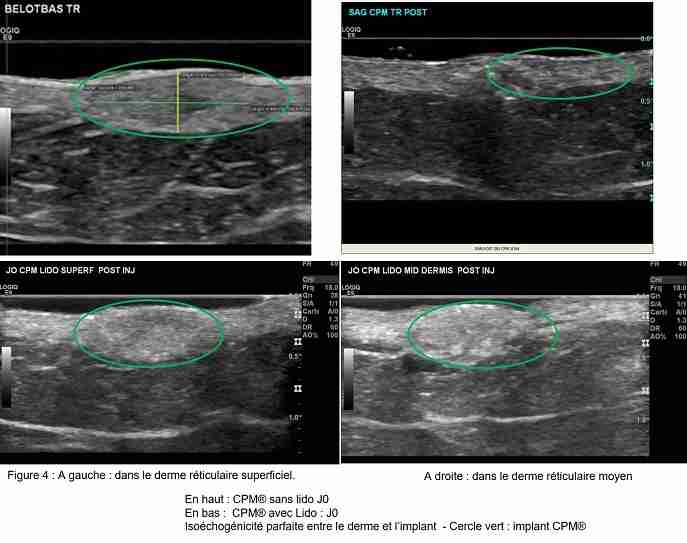
2. Injection dans le derme moyen.
Injection à J0 et suivi à J15 voire 45.
L’injection de CPM® sans lidocaïne dans le derme moyen montre un aspect proche de l’injection dans le derme réticulaire superficiel. A de rares occasions, nous avons observé une très discrète fuite du gel dans l’hypoderme.
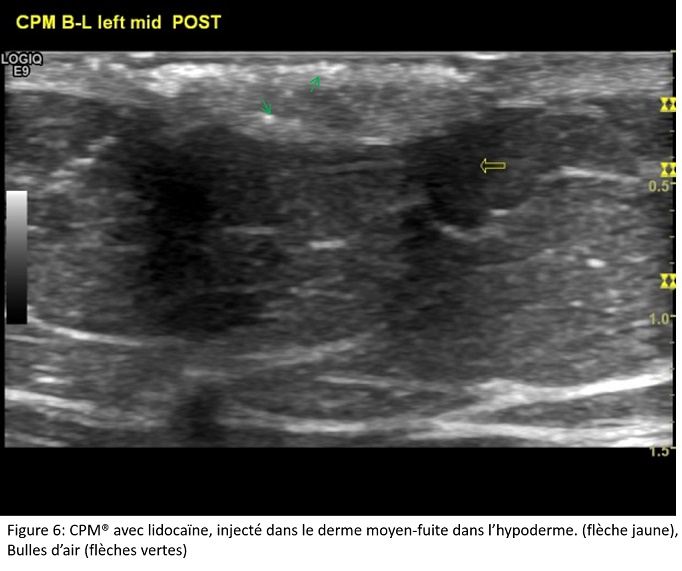
Le gel CPM® lidocaïne, injecté dans le derme réticulaire moyen, présente le même aspect que lors de son injection dans le derme réticulaire superficiel. Nous avons à plusieurs reprises observé la présence de bulle d’air au cours de l’injection du gel avec lidocaïne, malgré la purge de l’aiguille avant l’injection proprement dite, comme il se doit. (Fig 6)
Lors de l’injection dans le derme réticulaire moyen, nous avons observé que le gel CPM®, lidocaïne, pouvait présenter une discrète fuite dans l’hypoderme. Nous discuterons, plus loin, l’origine, possible, de cette fuite. (Fig 4)
Histologie
Injection dans le derme réticulaire superficiel.
a. CPM® sans lidocaïne
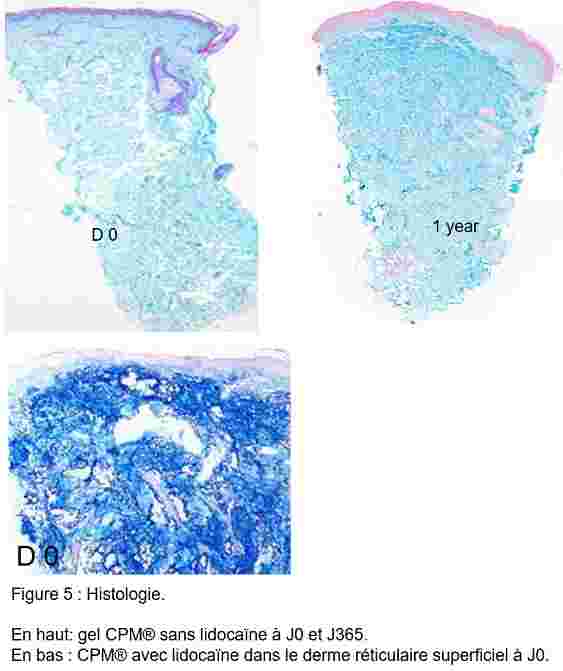
A J0
Toutes les biopsies en notre possession, ainsi que celles présentées par Rheinmuller et al, dans un article comparant 3 gels au bénéfice de l’approbation FDA (Ref 9, 10) montrent que le gel CPM® sans lidocaïne se distribue de manière harmonieuse sur toute la hauteur du derme. (Ref 3)
A J8, 15, 114 et jusqu’à J365.
Le gel CPM® sans lidocaïne présente une pérennité de sa diffusion sur toute la hauteur du derme, quel que soit le moment de la prise de biopsie. Nous n’avons jamais mis en évidence de réaction inflammatoire, même avec un suivi à 1 an après injection. (Fig 5 en haut)
b. CPM® lidocaïne
A J0
Les biopsies que nous avons pu réaliser avec le gel CPM® avec lidocaïne, ce dernier toujours injecté dans le derme superficiel, ne montrent pas de différence dans sa distribution, comparées aux biopsies avec le gel sans lidocaïne. (Fig 5 en bas)
A J45
Les biopsies sont superposables à celles du gel CPM® sans lidocaïne. Cependant, mentionnons qu’à J 45, il est remarqué une très discrète réaction inflammatoire lymphocy-taire, localisée dans le derme superficiel et moyen.
Injection dans le derme réticulaire moyen.
a. CPM® sans lidocaïne
Nous n’avons pas de biopsies de zones traitées par le gel CPM® sans lidocaine. Cependant, au vu des images ultrasonographiques, nous pensons que les images seraient proches de celle obtenues avec lidocaïne.
b. CPM® lidocaïne
A J0
Le gel CPM® lidocaïne se distribue de manière harmonieuse sur toute la hauteur du derme, image superposable à l’injection dans le derme superficiel. Cependant, le gel se retrouve plus dans les deux – tiers inférieurs du derme réticulaire. Sur les biopsies en notre possession, il n’y a pas de visualisation du gel dans l’hypoderme. Ceci est dû, probablement, à une prise de biopsie insuffisamment profonde. Aucune réaction inflammatoire n’a été mise en évidence à J0.
A J15 ou J45
Nous n’avons pas observé de réaction inflammatoire à J15 ou J45 sur les biopsies en notre possession.
Lorsque les biopsies contiennent de l’hypoderme, on observe la présence du gel. Ceci confirmerait le possible passage du gel, observé à l’échographie. (Fig 6)
Expérience clinique personnelle
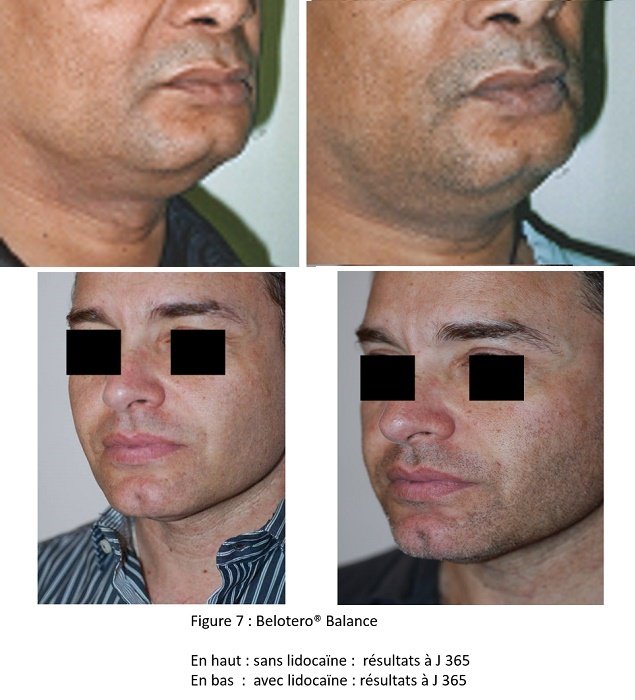
Nous avons injecté le gel CPM®, depuis sa demande d’enregistrement au sein de la CEE, soit 2004. (Fig 7)
Au cours des tests, nous avons corrigé la profondeur des injections avec le gel sans lidocaïne, pour arriver à une injection parfaite, avec une longue tenue dans le temps. En effet, nous avions découvert que le gel CPM® sans lidocaïne, de par sa technique de réticulation très spécifique, pouvait être injecté, exactement comme le collagène bovin (Ref 16, 17), dans le derme réticulaire superficiel, suivant la technique d’injection dite « Blanching technique ». (Ref 14,15), au contraire du gel, considéré comme le « gold standard », le gel NASHA®. Avec le gel CPM® sans lidocaïne, même injecté aussi superficiellement, nous n’avons jamais eu à déplorer l’apparition de cordons indurés, visibles ou palpables, ni d’effet Tyndall.
Pour rappel, la « Blanching technique » est réalisée par une injection points par points jointifs, biseau d’une aiguille 30½G implanté dans le derme (1 mm), avec un angle de pénétration compris entre 9 et 12° maximum. (Ref 14, 15)
Depuis 2013, nous injectons le gel CPM® lidocaïne (Ref 12), dans toutes les mêmes indications que celles que nous avions traitées avec le gel sans lidocaïne.
Bien que l’on nous ait présenté ce gel comme parfaitement identique au gel sans lidocaïne, ce qui se confirme par une grande partie des tests réalisés (voir ci-dessus), nous avons eu le même ressenti que lors de notre participation à une étude sur le gel Matrice 3 D® Juvéderm® Ultra 3, présenté comme du Surgiderm®, avec lidocaïne. (Ref 18)
Les tests réalisés au laboratoire Rheonova semblent confirmer nos impressions cliniques.
…La suite de ce contenu est réservée aux membres de l’AFME.
Pour voir l’article en entier, connectez-vous >
-
Note du comité de lecture 8.2
-
Notes Utilisateur (6 Votes)
7.9